 2019.11.29
2019.11.29  1936次
1936次
一、概述
成骨分化是骨生成的关键步骤,即骨髓间充质干细胞经历骨原细胞、成骨细胞最终分化为骨细胞的一个复杂的过程,其中涉及到多种类型细胞间和细胞内的信号传递,如信号通路、转录因子、生长因子、 MicroRNA 等,形成了一个完整的骨代谢调控负反馈环路[1]。成骨分化最基本的生物学特征是骨基质合成、分泌、矿化及成熟。
骨基质是钙化的细胞间质,包括有机质和无机质两种成分。有机质的主要成分是骨胶原纤维即骨胶原(bone collagen),由成骨细胞合成,主要由Ⅰ型胶原蛋白组成,另有一类是被称为无定形基质(ground substance)的非胶原蛋白,如骨钙素(OCN)、碱性磷酸酶(ALP)、骨桥蛋白(OPN)、骨结合素(ON)、骨唾液酸蛋白(BSP)、骨生长调节因子等。骨基质中的无机质为无机盐,按含量多少依次是磷酸钙、碳酸钙、柠檬酸钙,它们主要以羟基磷灰石的结晶形式分布于骨的有机质中。无定形的磷酸钙发展为羟基磷灰石结晶埋于骨的有机质间隙中的过程,通常称为骨矿化(bone mineralization)。
Runt相关转录因子2(Runx2)和Sp1转录家族成员Osterix/Sp7被认为是成骨分化调控网络的关键节点[2]。Runx2促进成软骨细胞和成骨细胞表达的主要胞外基质(包括ALP、OPN、OCN、BSP 、I型胶原和X型胶原)的表达[3,4],而且能够激活Osterix/Sp7表达[5]。Osterix/Sp7也驱动成骨细胞表达外基质,包括I型胶原、ALP、OC、OPN、BSP和OCN[6,7]。
二、成骨分化相关信号通路
1、BMP-Smads 信号通路
BMPs 在骨代谢过程中起着关键性的调控作用。BMPs 属于转化生长因子 β (TGF-β)超家族,是一类多效性细胞因子,根据序列相似性和功能可以将 BMPs 分为4个亚族:BMP-2和BMP-4,BMP-5、-6、-7、-8a 和-8b,BMP-9和BMP-10,BMP-3、-3b、-11、-12、-13、-14、-15 和-16。其中,BMP-2、-7、-6、-9 能够促进骨质形成[8],而 BMP-3 对成骨具有负调控作用[9]。TGF-β 超家族的成员均通过结合双受体系统——I型和II型跨膜丝氨酸/苏氨酸激酶受体(BMPR-I、BMPR-II)介导信号转导。而在膜信号传入核内的过程中,Smad 信号通路发挥着主要作用。
BMP 信号分子结合并激活 BMPR-II,使BMPR-I 磷酸化并进一步磷酸化BMP 活化型 Smads(BR-Smads,为Smad1、5、8)的 C 末端 DNA 结合域,磷酸化的BR-Smads 与共同通路型Smads(Co-Smads,为Smad4)结合形成异质低聚体进入核内与转录因子相互作用(如图1所示),共同激活成骨细胞特异性转录因子(Runx2、 Sp7等)表达,从而诱导 MSCs 向成骨细胞分化及骨形成 [10-12]。在骨髓间充质干细胞(BMSCs)中 BR-Smads 又可以与 Runx2 以物理结合的方式进一步诱导成骨分化[13]。BMP-Smads 信号通路上调Msx2表达,而Msx2促进Osterix/Sp7表达,这一过程不依赖Runx2[14]。I-Smads可以抑制 BR-Smads 和Co-Smads 的作用。此外,Samds 的活性还受到许多因素的调控。小C端结构域磷酸酶1、2 (SCP-1、 SCP-2)介导 Smads 的去磷酸化可抑制后者的转录活性[15]。E3泛素连接酶1(Smurf1)使 Smad1、 5泛素化而被 26S 蛋白酶体识别和降解[16],Smurf2仅介导Smad1泛素化 [17]。
此外BPM2信号促进E1A结合蛋白p300介导的Runx2乙酰化,而乙酰化增强Runx2的转录激活活性,并且抑制Smurf1介导的Runx2泛素化降解。HDAC4和HDAC5使Runx2去乙酰化,允许Runx2被Smurf1泛素化而降解[18]。
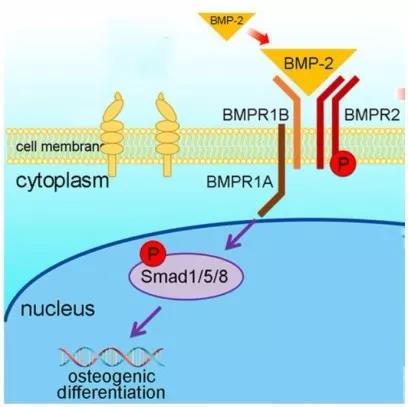
图1 BMP-Smads 信号
2、Wnt/β-Catenin 信号通路
Wnts是一类与卷曲蛋白受体(FZD)结合的分泌型糖蛋白。Wnt家族参与细胞极化、分化、迁移、增殖和生物学功能等多个细胞生理过程。Wnt 蛋白可以大致分为两类:一类激活经典的 Wnt信号通路,即 Wnt/β-Catenin 信号通路;另一类由Wnt5a 激活非经典的Wnt通路,配体与FZD结合后不依赖于β-Catenin 和 LRP5/6。
Wnt/β-Catenin经典信号通路中,Wnt 配体与 FZD 或低密度脂蛋白受体相关蛋白 5/6 (LRP5/6)形成复合物。当胞外缺乏Wnt蛋白时,该复合体无法形成,此时轴蛋白2(Axin2)、糖原合酶激酶 3β(GSK-3β)、大肠腺瘤样蛋白(APC)、肌酸激酶1(CKMT1) 等组成复合体,该复合体可降解β-Catenin,胞浆及核内的 β-Catenin水平降低,最终抑制Wnt/β-Catenin 信号通路;当 Wnt 分子与LRP5/6-FZD 受体复合体结合, LRP5/6 胞内端磷酸化而产生轴蛋白 Axin2 的结合位点,Axin2 结合到该位点能抑制 GSK-3β介导的β-Catenin 水解,引起 β-Catenin 增加并进入核内,与细胞核中的 T 细胞因子(TCF)/淋巴增强因子(LEF)转录复合物结合(如图2所示),作为转录激活因子可引起下游靶基因表达,从而发挥调控作用[19]。
经典Wnt信号通路在调节成骨细胞分化及骨形成方面是通过作用于Runx2起作用。Runx2 基因启动子序列包含一个 TCF作用元件,它能将β-catenin 及 TCF1 募集到该位点,继而启动 Runx2及下游靶基因的表达,从而调节成骨细胞分化及骨形成[20]。此外LRP5 能通过上调 Runx2及ALP的表达促进 MSCs 向成骨细胞分化,同时下调 CCAAT 增强子结合蛋白 α 及过氧化物酶体增殖物激活受体 γ 的表达来抑制脂肪形成[21]。
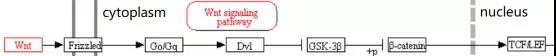
Wnt/β-Catenin 信号通路
3、Notch 信号通路
Notch 信号通路在进化上高度保守,其在细胞发育、增殖、凋亡和分化均具有调控作用。Notch 本身是一类在进化上高度保守的受体蛋白,在哺乳动物中 Notch 受体的同源分子有 4 种,分别为 Notch1、 2、 3、 4。配体同源分子目前已知有12种,根据结构不同将 12 种配体分为四类。Notch 的受体和配体为跨膜蛋白,其发挥功能依赖于相邻细胞间的相互接触。
当相邻细胞表面的同源配体与受体结合,Notch受体的胞外部分和跨膜部分分别经 TACE、 γ-分泌酶水解,引起 Notch 受体胞内部分(NICD)从细胞膜上脱落并移入核内。在细胞核中 NICD 与 RBPJ、 MAML相互作用,将转录抑制子转化为激活子,激活下游 HES 家族、 HEY 家族等的基因表达[22]。
NICD 过表达的 MC3T3-E1 细胞在成骨分化过程中钙结节的形成量显著增加,外源性 Notch 可以诱导多能间充质细胞系(C3H10T1/2)成骨分化,抑制成脂分化[23]。Notch下游基因 Hes-1能与 Runx2 相互作用并增强后者作为转录激活子的活性,Notch 信号通路的激活子Maml 也能够激活骨组织 Runx2 的转录[24]。Notch信号通路也通过转录激活Osterix /Sp7,以及上调细胞周期蛋白D 和周期蛋白 E 来实现的提高成骨细胞增殖能力[25]。
4、Hedgehog 信号通路
Hedgehog 信号通路同样在进化上高度保守,在发育和内稳态方面起着重要作用。Hedgehog是一类分泌型信号蛋白,在哺乳动物体内可分为三类:Sonic Hedgehog (SHH), Indian Hedgehog (IHH), Desert Hedgehog (DHH)。当胞外 Hedgehog 蛋白与跨膜受体(Ptch1)结合即解除对SMO抑制并进一步使之磷酸化,活化的 SMO与 Cos2、 Fu 结合形成复合物,该复合物可激活锌指蛋白家族 Ci/G li,促使它们进入核内聚集并激活转录,从而启动下游靶基因表达[26]。
SHH 能上调成骨细胞系Osterix /Sp7的表达,促进成骨细胞产生并间接上调破骨细胞的活力[27]。IHH通过Gli2上调 Runx2 的表达来调控成骨细胞分化[28]。Ptch1缺陷的成骨前体细胞由于与Runx2 的反应性增加及 GLI3 抑制物产生减少而表现为成骨分化速度增快[29]。
5、MAPK 信号通路
传统的丝裂原活化蛋白激酶(MAPKs)包括三个亚家族成员:ERK1/2、 ERK5, JNK1/2/3, p38。MAPK 通路主要参与转导胞外刺激(环境压力、生长因子、细胞因子等)引起细胞生长、分化和凋亡。一旦细胞接触刺激物, MAPKK 激酶(MAP3K)被激活并磷酸化 MAPK 激酶(MAP2K),而后磷酸化激活MAPKs [30]。
ERK1/2通过促进Runx2 磷酸化诱导成骨分化[30],ERK1/2 特异的丝氨酸残基(Ser301、 319)与 Runx2 的激活能力有关[31]。p38被 BMP 激活后通过促进SMAD1磷酸化及核定位促进成骨分化[32]。PTH具有通过蛋白激酶A(PKA)激活 p38 调控成骨细胞的功能,说明 PTH是 p38 上游分子之一[38]。
6、FGF 信号通路
成纤维细胞生长因子(FGFs)家族由 22 个分泌性多肽组成,能与 4 个高度同源的酪氨酸激酶受体(FGFR1-4)结合,引起 FGFR 二聚化并磷酸化自身的酪氨酸残基,以激活多个信号转导途径及下游基因,具有调控多种生长相关进程的作用,包括软骨内成骨和膜内成骨[34]。
FGF-2 可诱导人 MSCs 中 ALP 的表达,但并不改变骨钙素 mRNA 的表达水平,表明 FGF-2 可能参与了成骨细胞分化早期的调节[35]。此外,FGF-2 可诱导 Runx2 发生磷酸化并活化,从而调节成骨细胞分化[36]。FGF 信号通路也可通过激活BMP-2和Runx2的表达来调控成骨分化及骨形成 [37,38]。
三、总结
成骨分化是一个涉及多步骤的复杂生理过程,目前已证实多条信号通路在这一过程中起重要的调控作用,其中多个信号路通直接或间接影响 Runx2、Osterix /Sp7等成骨关键转录因子的表达,最终调控成骨分化。成骨分化相关的多条通路相互联系相互作用,构成了一个复杂的网络,协同参与骨细胞分化及骨形成的调节。
参考文献
[1] Hankenson KD, Gagne K, Shaughnessy M. Extracellular Signaling Molecules to Promote Fracture Healing and Bone Regeneration. Adv Drug Deliv Rev. 2015, 94: 3-12.
[2] Komori T. Regulation of Osteoblast Differentiation by Transcription Factors. J Cell Biochem. 2006, 99(5): 1233-9.
[3] Ducy P, Zhang R, Geoffroy V, Ridall AL, Karsenty G. Osf2/Cbfa1: a transcriptional activator of osteoblast differentiation. Cell. 1997, 89(5): 747–54.
[4] Banerjee, C., McCabe, L. R., Choi, J. Y., Hiebert, S. W., Stein, J. L., Stein, G. S., and Lian, J. B. Runt homology domain proteins in osteoblast differentiation: AML3/CBFA1 is a major component of a bone-specific complex. J Cell Biochem. 1997, 66: 1–8.
[5] Nakashima K1, Zhou X, Kunkel G, Zhang Z, Deng JM, Behringer RR, de Crombrugghe B.The Novel Zinc Finger-Containing Transcription Factor Osterix Is Required for Osteoblast Differentiation and Bone Formation. Cell. 2002, 108(1): 17-29.
[6] Nakashima K, Zhou X, Kunkel G, Zhang Z, Deng JM, Behringer RR, Crombrugghe de B. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation. Cell. 2002, 108(1): 17–29.
[7] MatsubaraT, Kida K, Yamaguchi A, Hata K, Ichida F, Meguro H, Aburatani H, Nishimura R , Yoneda T. BMP2 Regulates Osterix through Msx2 and Runx2 during Osteoblast Differentiation. J Biol Chem. 2008, 283(43): 29119-25.
[8] Peng Y, Kang Q, Cheng H, Li X, Sun MH, Jiang W, Luu HH, Park JY, Haydon, RC, He TC. Transcriptional Characterization of Bone Morphogenetic Proteins (BMPs)-Mediated Osteogenic Signaling. J Cell Biochem. 2003, 90 (6), 1149-65.
[9] Daluiski A, Engstrand T, Bahamonde ME, Gamer LW, Agius, E, Stevenson SL, Cox K, Rosen V, Lyons KM. Bone Morphogenetic Protein-3 Is a Negative Regulator of Bone Density. Nature Genetics. 2001, 27 (1), 84-8.
[10] Hong JH, Hwang ES, McManus MT, Amsterdam A, Tian Y, Kalmukova R, Mueller E, Benjamin T, Spiegelman BM, Sharp PA, Hopkins N, Yaffe MB. TAZ, a transcriptional modulator of mesenchymal stem cell differentiation. Sc



 返回列表
返回列表