 2019.11.29
2019.11.29  1345次
1345次
一、背景
PD-1检查点封锁的免疫疗法虽然显著,但疗效依然无法持续,仍需要寻找新的免疫治疗靶标协同治疗。在这里,作者以CRISPR-Cas9基因组编辑技术作为筛选方法,在免疫疗法治疗的荷瘤小鼠体内筛选基因,筛选与检查点封锁(PD1-PDL1)协同作用或对检查点封锁耐药的基因并做了验证。
二、研究结果
作者首先构建B16黑色素瘤细胞系稳转表达Cas9(补充图1a),并验证了靶向PD-L1的小向导RNA(sgRNA)有效编辑(补充图1g)。

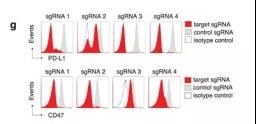
补充图1a和1g
作者用黑色素瘤细胞高表达的2368个基因作为CRISPR-Cas9库筛选靶标,构建慢病毒敲除(KO)文库,该库编码9872个sgRNA,靶向2368个基因,并且,这些基因在肿瘤细胞系中的表达水平足以被检测到(补充图1b)。
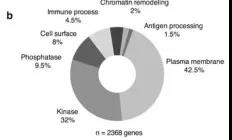
补充图1b
肿瘤细胞体外进行基因编辑后,移植到动物体内,用分泌粒细胞巨噬细胞集落刺激因子(GM-CSF)的放射线照射的肿瘤细胞疫苗(GVAX)单独治疗、使用针对PD-1的抗体单独治疗、GVAX与PD-1抗体结合治疗,以产生对肿瘤细胞足够的免疫选择压力(图1b和补充图1c)。同时,将经文库转导的肿瘤细胞移植到缺乏CD4 +和CD8 +T细胞的Tcra - / -小鼠中(无法在肿瘤上施加适应性免疫的选择压力)。在12-14天后,收集了肿瘤(图1b和补充图1c),并将免疫治疗后的野生型动物的肿瘤中的文库表示与在Tcra - / -小鼠中生长的肿瘤进行了比较。这一步,验证了Tcra - / -小鼠对肿瘤没有适应性免疫选择压力,说明Tcra - / -小鼠适合用做体内筛选模型的对照组。
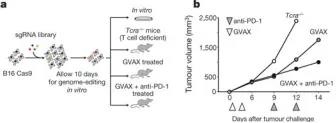
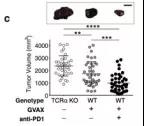
图1a、1b和补充图c
在12-14天后,将免疫治疗后的野生型动物的肿瘤中的文库表示与在Tcra - / -小鼠中生长的肿瘤进行了比较(补充图1d–f,h)。用免疫疗法治疗肿瘤中被耗竭的sgRNA靶向的基因中出现了已知的免疫逃逸分子PD-L1,这表明PD-L1的敲除增加了肿瘤细胞对免疫攻击的敏感性。
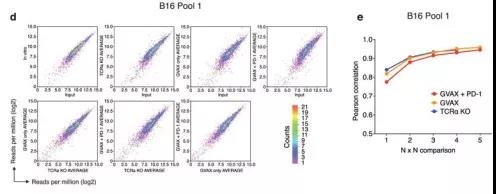


补充图1d–f,h
Tcra - / - VS in vitro显示,靶向PD-L1的sgRNA在Tcra - / -的肿瘤中没有耗竭,这可能是因为Tcra - / -缺乏T细胞介导的免疫选择压力(图1c)。而在接受GVAX治疗的野生型荷瘤小鼠中,这些基因却比Tcra - /- 型小鼠显着耗竭了(错误发现率(FDR)= 0.004)。但是,在用GVAX联合抗PD-1治疗的肿瘤中靶向PD-L1的sgRNA没有耗竭,这表明当阻碍PD-L1-PD-1相互作用,PD-L1的治疗没有选择压力(图1c)。
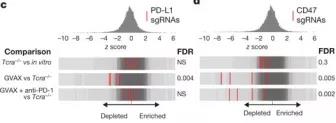
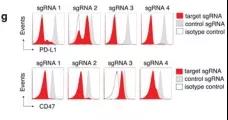
图1c、1d和补充图1g
用GVAX或GVAX和PD-1阻断剂治疗的肿瘤中,靶向CD47(高表达的CD47到表面的细胞会被巨噬细胞当作“正常细胞”实现免疫逃逸)的sgRNA 明显减少(分别为FDR = 0.005,FDR = 0.002) (图1d和补充图1g)。为了证实CD47无功能的肿瘤更易受GVAX和PD-1阻滞,作者使用Cas9-sgRNA质粒的瞬时转染制备了CD47无功能的B16黑色素瘤细胞(补充图2a),发现CD47的丢失明显提高了GVAX和抗PD-1免疫疗法介导的肿瘤生长的抑制(补充图2b,P

补充图2e~g
1、增强免疫疗法功效的基因靶标
在免疫疗法治疗的小鼠中的50个最耗尽的基因中(全部FDR
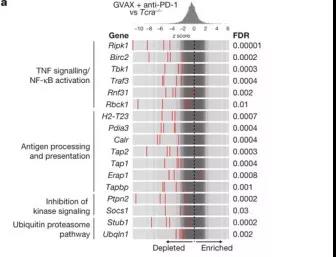
图2:KO筛选有助发现新的免疫疗法靶标
根据STARS算法最高累积得分排名,从这四个组中分别选择了一个代表基因进行验证:Ptpn2(一种磷酸化酶)、H2-T23(非经典的MHC-1基因)、Ripk1(调节细胞死亡和炎症的激酶)、STUB1(参与未折叠蛋白应答的调节的E3泛素连接酶)。体内竞争试验表明,在免疫疗法治疗的动物中,针对四个基因中任意一个基因敲除的肿瘤细胞都有显著的生长优势,但是在体外和Tcra- / -小鼠中,它们的生长速率与控制肿瘤细胞的速率相同。(图2b,c)。这表明这些基因功能的丧失使肿瘤细胞对免疫疗法更加敏感(在没有T细胞的情况下,这些基因功能丧失的肿瘤生长正常)。
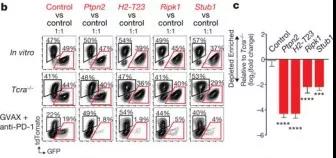
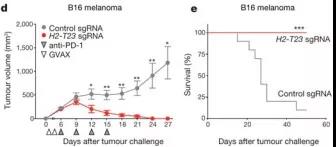
H2-T23编码Qa-1b(人类中的HLA-E),这是一种非经典的MHC分子,与T细胞和自然杀伤(NK)细胞上的抑制性受体NKG2A结合。通过比较B16黑色素瘤H2- T23-敲除细胞的生长(图4g),发现Qa-1b功能的丧失增强了免疫疗法疗效。对照肿瘤的免疫疗法仅根除10个肿瘤中的1个,H2-T23敲除肿瘤的免疫疗法在所有10只动物中均治愈(图2d,e;P
2、肿瘤敲除Ptpn2后,对免疫治疗更敏感
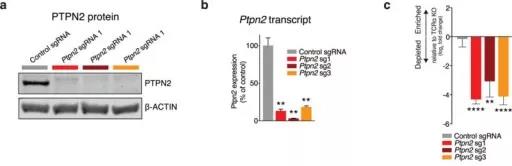
在体内竞争试验中,观察免疫疗法对 Ptpn2功能敲除的肿瘤疗效,Ptpn2- null的肿瘤对免疫治疗的敏感性显着更高(图3a)。在没有T细胞或没有免疫疗法的情况下,Ptpn2功能敲除的肿瘤细胞在体内没有生长不利的条件(见原文补充图5a–d)。在T细胞免疫型Braf / Pten基因的黑素瘤模型(图3b和补充图4F。)、MC38结肠癌模型(补充图5)中PTPN2的损失也增加了免疫治疗的灵敏度。因此,肿瘤敲除Ptpn2后,对免疫治疗更敏感。
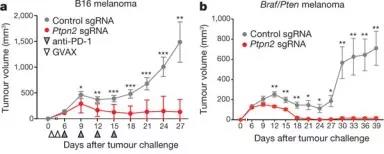
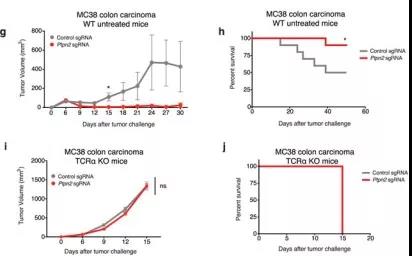
图3:肿瘤敲除Ptpn2后,对免疫治疗更敏感
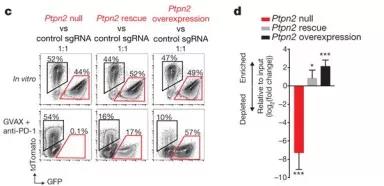
在敲除 Ptpn2的肿瘤细胞中的重新表达PTPN2(即Ptpn2恢复试验),解除了对免疫疗法的敏感性(图3c,d),排除了基因编辑的脱靶作用增加对免疫疗法敏感性的可能。此外,过表达PTPN2的B16肿瘤细胞在免疫疗法治疗的小鼠中肿瘤增加(图3c,d),这表明增加PTPN2 表达恢复了肿瘤细胞对免疫疗法的抗性。
为了确定PTPN2扩增是否与人类癌症的免疫治疗抗性相关,作者检查了接受PD-1,PD-L1或CTLA-4阻断治疗患者的外显子组测序数据。在20例患者中发生PTPN2扩增,但是这些事件大多数是染色体水平或臂水平扩增,仅在两名患者中发生局灶性扩增,数量太少,无法确定PTPN2扩增是否是耐药机制(补充图6)。
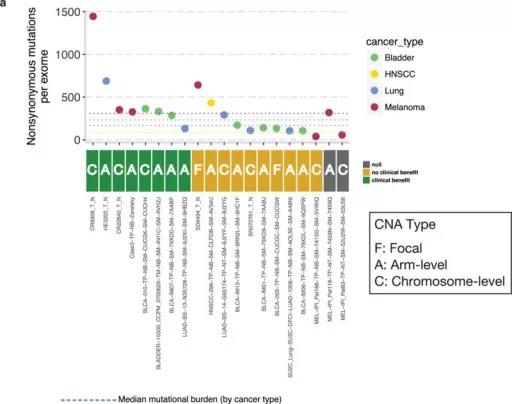
补充图6
Ptpn2丢失会增加肿瘤的抗原呈递
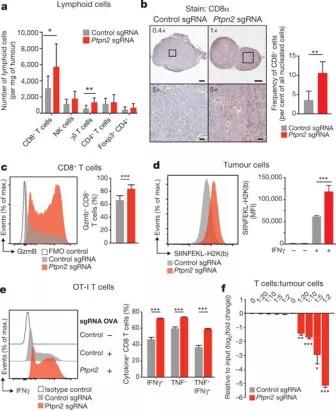
图4:Ptpn2的敲除改善了抗原呈递和T细胞刺激
为了测试Ptpn2阴性肿瘤中细胞毒性CD8 + T细胞数量的增加是否是通过增加抗原呈递而提高了对肿瘤细胞的识别。作者在Ptpn2 - null或对照B16细胞中表达了全长卵清蛋白(OVA )抗原。发现Ptpn2-敲除细胞中对OVA抗原的SIINFEKL-H2Kb表位的单抗染色更多,这表明Ptpn2的敲除增加了肿瘤细胞表面上载有抗原的MHC-1的水平(图4d)。此外,Ptpn2与对照细胞相比,敲除细胞在用IFNγ处理后总MHC-1 含量增加(补充图9a)。
为了测试Ptpn2的敲除是否使肿瘤细胞更易于识别为T细胞,作者用识别SIINFEKL表位的OT-1 CD8 + T细胞与表达OVA的Ptpn2 – null和对照细胞共培养。通过细胞内IFNγ和TNF染色发现,用Ptpn2-敲除的OVA-B16 细胞培养的T细胞的活化明显更高(图4e)。为了测试Ptpn2- null肿瘤细胞是否对T细胞更敏感,作者将表达OVA的Ptpn2 - null或野生型B16细胞与抗原特异性CD8 + T细胞混合培养了六天,发现缺乏Ptpn2的肿瘤细胞存在比例下降(图4f)。因此,肿瘤细胞中Ptpn2的敲除增加了抗原呈递和对细胞毒性CD8 + T细胞的敏感性。
3、Ptpn2的敲除会增加肿瘤细胞对IFNγ的敏感性
根据先前报道,PTPN2通路与IFNγ有关,作者分析了响应IFNγ刺激的Ptpn2敲除细胞中的STAT1活性。在用IFNγ处理后,Ptpn2-敲除的B16细胞显示磷酸化的p-STAT1增加,而Ptpn2的过表达抑制了该磷酸化(图5a)。对IFNγ、TNF或两者处理的Ptpn2敲除和对照B16肿瘤细胞做转录分析,发现Ptpn2的敲除会导致IFNγ处理后IFNγ响应基因的表达谱发生显着变化,但在未刺激的条件下不会改变基因表达,仅在TNF刺激后(图5b)。在四种PTPN2的功能丧失的人类肿瘤细胞系中,IFNγ刺激后,IFNγ反应基因的表达也增加(图5c;FDR
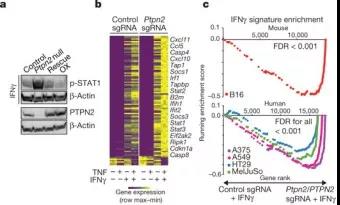
图5a~c:Ptpn2的敲除增加肿瘤对IFNγ敏感性
细胞周期调节剂(例如Cdkn1a)和一些参与凋亡的基因(例如Casp4,Casp8,Ifit2,Ripk1和Bak1)在用细胞因子处理的Ptpn2敲除肿瘤细胞中相对于野生型肿瘤细胞显着上调。与这一发现一致的是,单独或与IFNβ或TNF联合使用IFNγ后,会显着降低Ptpn2- null小鼠肿瘤细胞系(图5d)和人的肿瘤细胞系肿瘤生长(相对于野生型)(图5e)。这些结果表明,单独使用IFNγ足以抑制Ptpn2 / PTPN2敲除小鼠和人类肿瘤细胞生长。
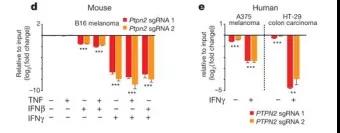
图5d和图5e Ptpn2的敲除增加肿瘤对IFNγ敏感性
4、Ptpn2敲除提高了免疫疗法的疗效,依赖IFNγ通路
为了确定Ptpn2敲除细胞对免疫治疗敏感性提高的机制是否取决于IFNγ信号传导,作者制备了Ptpn2敲除,Stat1,Jak1,Ifngr1或Ifnar2也已被剔除的B16肿瘤细胞系(图5f)。
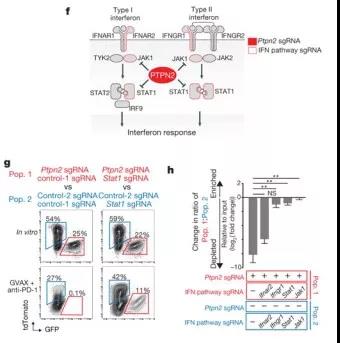
图5f,g,h
GVAX和抗PD-1免疫疗法治疗的动物中测试了这些双敲除细胞相对于仅敲除Stat1,Jak1,Ifngr1或Ifnar2的肿瘤细胞的生长。Ptpn2单独敲除的肿瘤生长处于劣势(图5g,h),符合预期。同时敲除IFNγ下游任何一个基因,都会使原来生长不利的Ptpn2- null细胞(0.1%)恢复生长比例(11%)(图5g,h)。Ifnar2(一种检测I型干扰素的基因)的丢失并没有消除Ptpn2- null肿瘤对GVAX和抗PD-1免疫疗法的敏感性(图5h)。该遗传上位实验(genetic epistasis experiment)表明,在无法响应IFNγ信号的肿瘤细胞中,Ptpn2缺乏不能使肿瘤细胞对免疫疗法敏感。因此,Ptpn2敲除使肿瘤细胞对免疫疗法是否敏感,取决于对IFNγ的通路响应。
三、结论
作者利用CRISPR-Cas9编辑库在体内做了KO的遗传基因筛选,为免疫肿瘤靶标发现提供了一种新方法。筛选出已知的免疫逃逸分子PD-L1和CD47,并发现干扰素-γ信号传导的敲除引起了对免疫疗法耐药的机制。敲除肿瘤的NF-κB信号传导、抗原呈递和未折叠的蛋白质反应等基因,可以提高免疫疗法的疗效。此外,肿瘤细胞中蛋白质酪氨酸磷酸酶PTPN2的功能敲除提高了免疫疗法的疗效,主要是通过增强IFN-γ介导的对抗原呈递和生长抑制这两个信号通路实现的。



 返回列表
返回列表