 2022.05.25
2022.05.25  2310次
2310次

本期分享的一篇文章是来自上海大学陈雨教授团队在2021年4月份发表在《Nature Communication》的一项关于2D V2C MXenzyme 用于减轻ROS介导的炎症和神经退行性疾病的工作。文章题目:2D vanadium carbide MXenzyme to alleviate ROS-mediated inflammatory and neurodegenerative diseases,影响因子:14.919,文章地址:https://doi.org/10.1038/s41467-021-22278-x.
一、背 景
1 活性氧在低浓度下对细胞功能调节具有重要作用,过量和失衡会导致氧化应激,造成一系列的不可逆破坏,包括DNA损伤,脂质体过氧化,蛋白质变性等,进而引发动脉粥样硬化、神经退行性疾病、炎症、衰老、血色素沉着症,甚至癌症。因此,为了缓解其有害影响,严格的ROS调控对于维持细胞稳态至关重要。
2 体内的天然抗氧化酶对于维持氧化还原稳态具有重要的作用但是由于其独特的化学组成(RNA/蛋白质)易受环境因素的影响导致酶活性丧失。为了解决这一问题,具有类酶活性的纳米材料,统称为纳米酶因其易于制备、高稳定性和可调的酶活力引起了研究人员越来越多的关注。目前报道过的有Fe/Cu/Carbon、Au/Pt/V-基纳米酶等。其中文献中报道的V-based纳米酶大都只有一种酶活性,限制其体内抗氧化中的实际应用。
3 过渡金属碳化物和/或氮化物(MXenes),是一类广泛用于储能和生物医学的优越的二维(2D)材料,这归因于它们的多功能组成、物理化学多样性和可调制性,但是其在ROS介导的炎症和神经退行性疾病中的应用仍有待进一步考查。
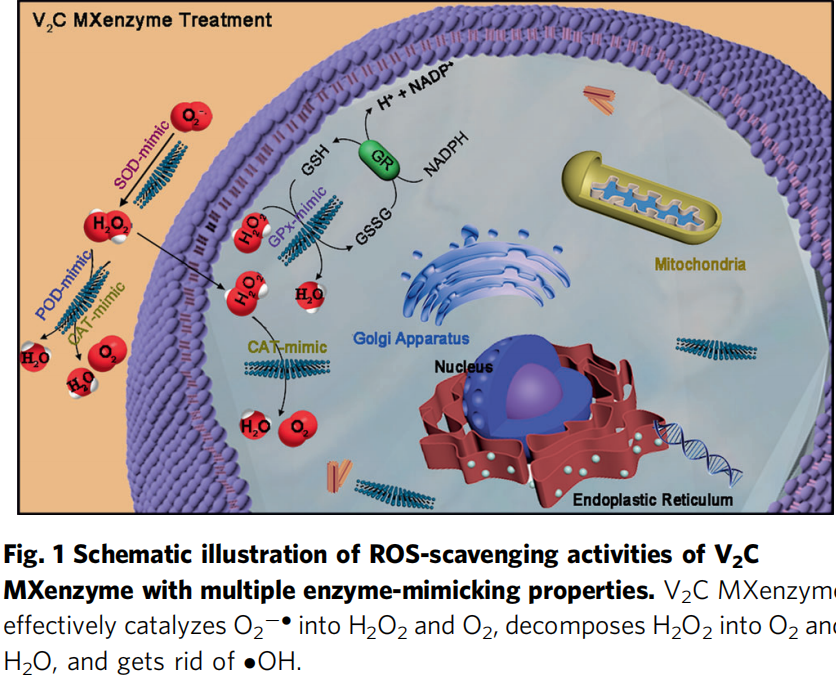
二、结果与讨论
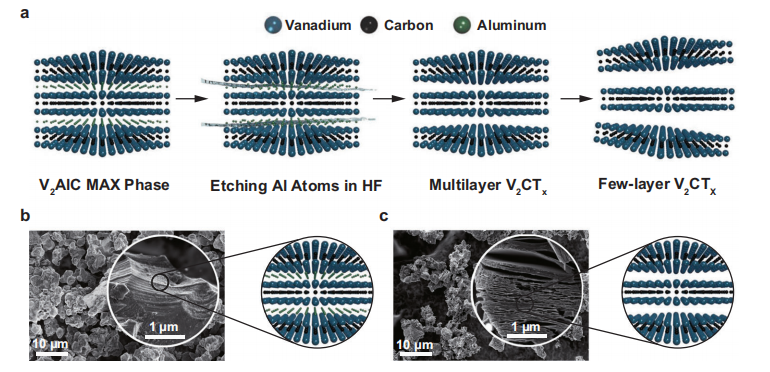
1、2D V2C MXene的合成和表征
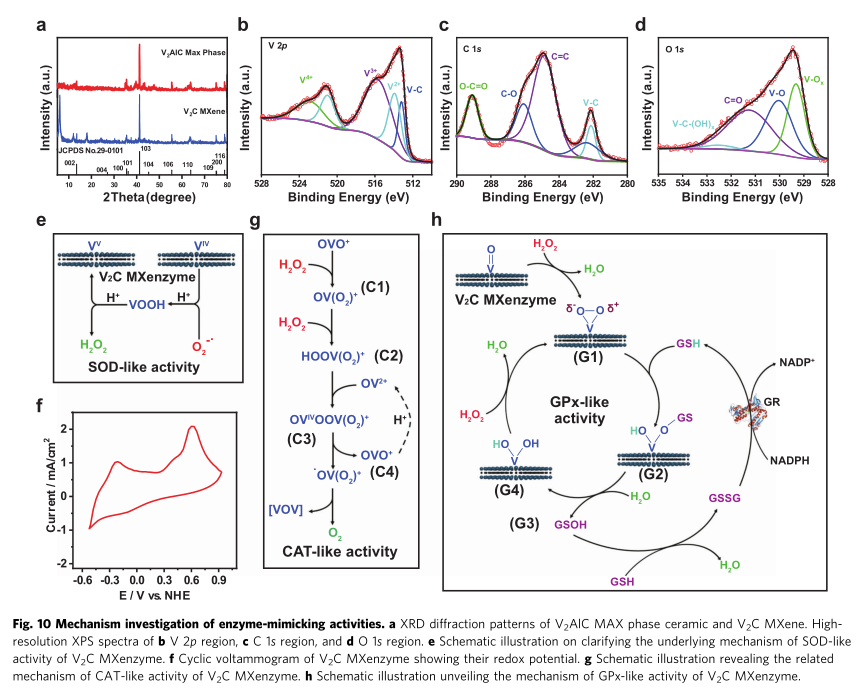
该纳米酶通过对V2AlC进行氢氟酸蚀刻而后经氢氧化四丙基铵插层来合成的。FESEM图中可知,初始V2AlC表现出紧密的层状板态。经过HF处理后,紧凑的层膨胀形成松散的手风琴形多层结构,说明其成功剥落。EDX图谱显示出V2AlC含有均匀分布的V, Al, C元素,而V2C MXenes由于氢氟酸的蚀刻,导致Al元素选择性去除,显示出V, C, O, F元素图谱。为了进一步证实具有少量层状的六角晶格的V2C MXenes的成功合成,作者又通过TEM(SAED)/HRSTEM等来表征;

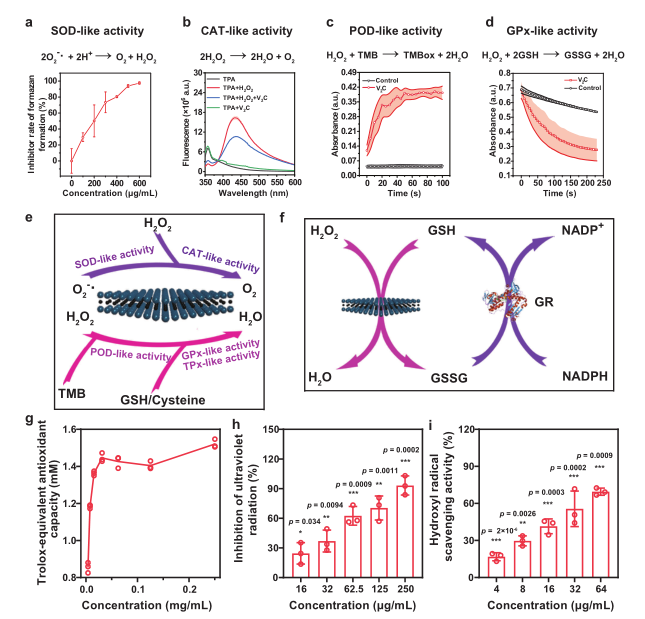
2、2D V2C MXenzyme的类酶活性以及活性氧去除能力
研究人员首先对2D V2C MXenzyme的多重酶活性进行评估,通过WST-1测定其SOD-like活性,利用对苯二甲酸/O2的生成量来测定其CAT活性,3, 3’, 5, 5’-四甲基联苯胺来测定其过氧化物酶活性(POD),利用NADPH的减少量来评估其谷胱甘肽过氧化物酶活性(GPx),含巯基半胱氨酸/卤族元素来测定其硫醇过氧化物酶活性/卤过氧化物酶活性(TPx/HPO),结果均表明该2D V2C MXenzyme具有优异的多重抗氧化酶活性,优于目前报道的如CuxO/Fe-N/C/PBs/N-MSNs等纳米酶,具有广谱活性氧清除能力。随后通过与Trolox (TR)典型的抗氧化剂的抗氧化能力对比、UV诱导活性氧生成抑制以及羟基自由基去除实验来进一步评估该V2C MXenzyme的活性氧清除能力,结果表明该V2C MXenzyme具有显著的活性氧去除能力,且这种能力具有浓度依赖性。
3、V2C MXenzyme对体外细胞的氧化应激保护作用
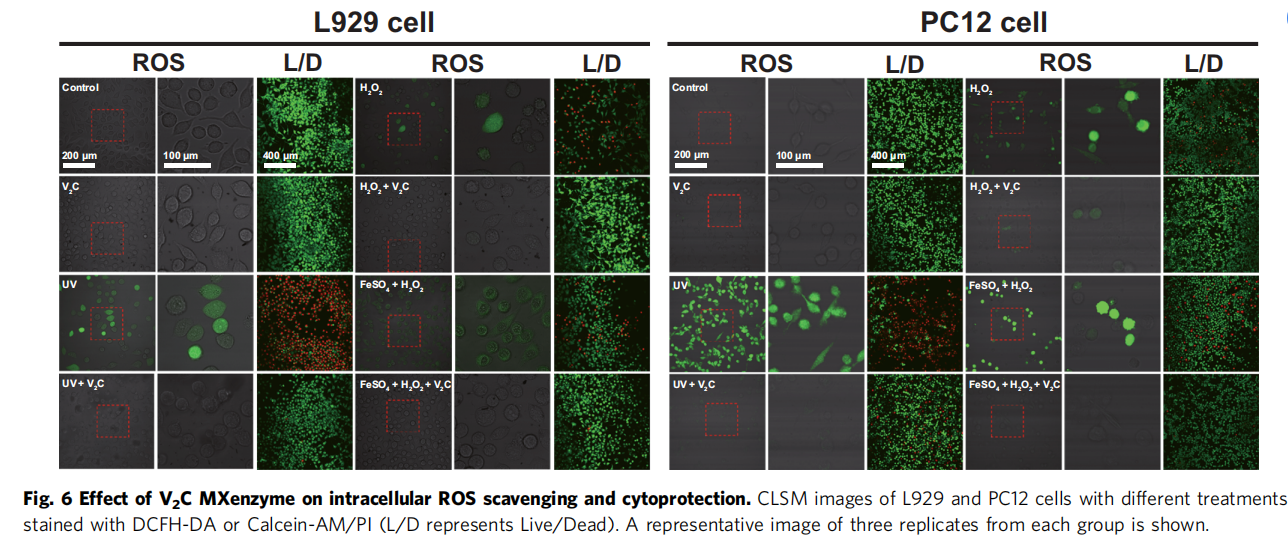
为了评估该纳米酶对细胞的氧化应激保护能力,研究人员首先验证了该材料的细胞毒性,结果表明,该材料在高达200 mg/mL时,仍然没有明显的细胞毒性。L929和PC12细胞的摄取实验则表明, V2C MXenes是通过内吞途径进入细胞。使用阿米洛利或制虫抑素处理对RB标记的V2C MXenes的内吞作用均有显著的抑制作用,表明该材料在细胞中的摄取涉及小窝/脂质介导的内吞作用和微胞吞作用。进而利用V2C MXenzyme来干预UV/H2O2诱导L929和PC12细胞氧化应激考察材料的保护效力,结果表明该纳米酶可以有效减轻氧化应激损伤,维持细胞活力。总之,V2C MXene酶的高效细胞内摄取、显著的ROS消除和细胞保护能力,使其成为一种有效的治疗ROS相关疾病的人工抗氧化酶。
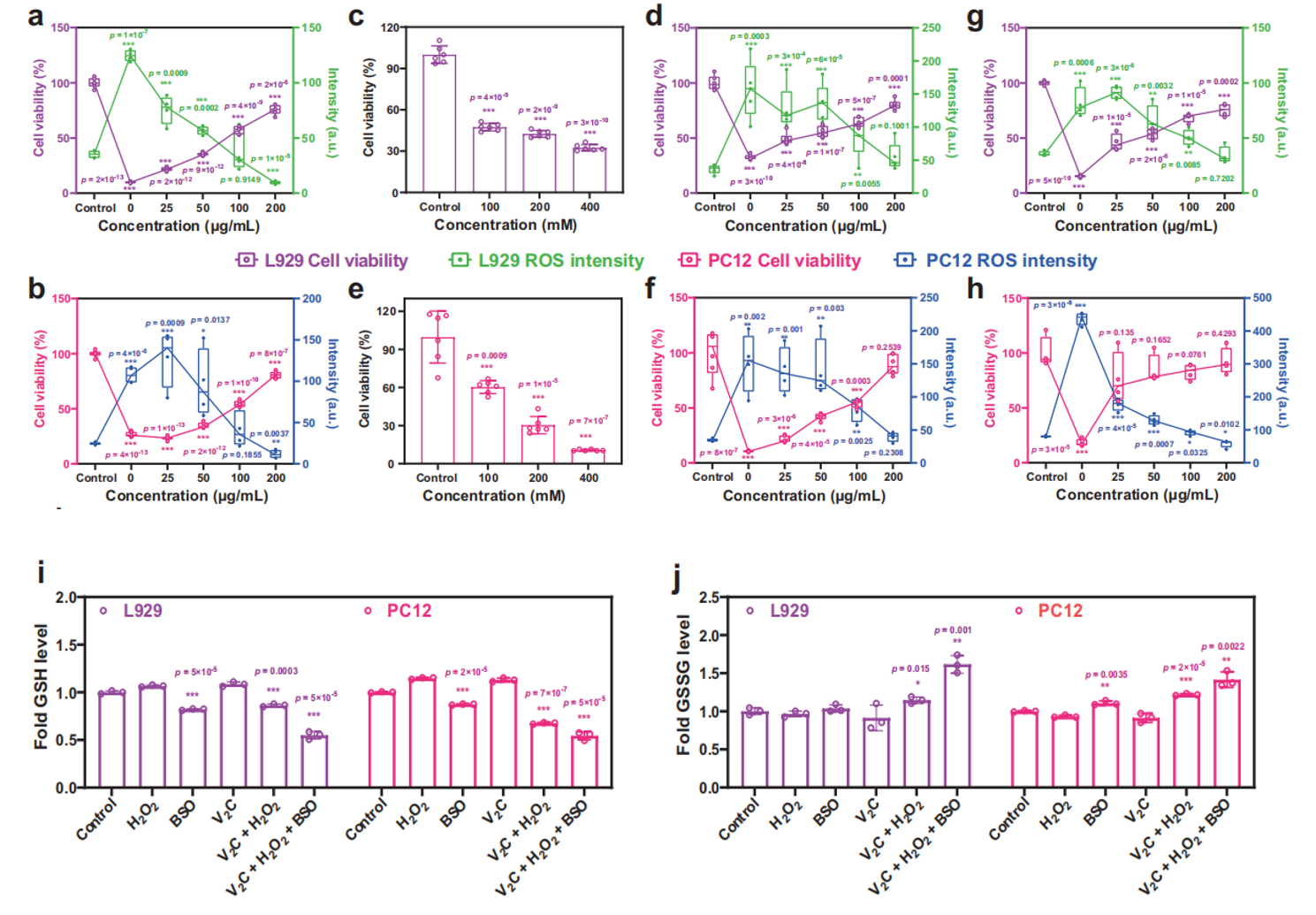
4、V2C MXenzyme对ROS介导细胞内成分的保护作用
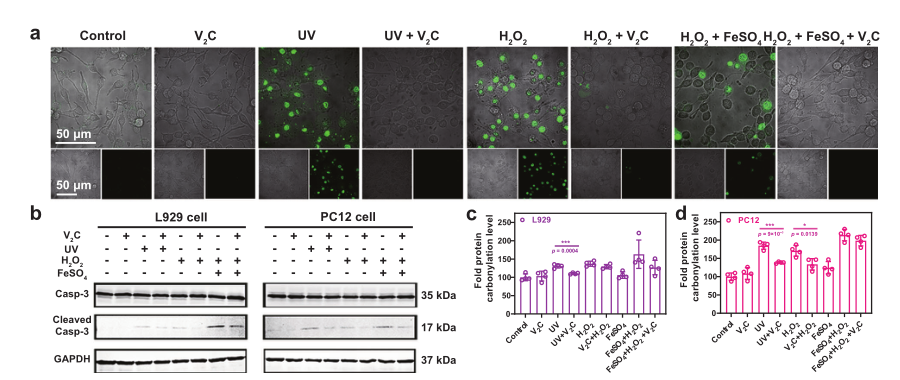
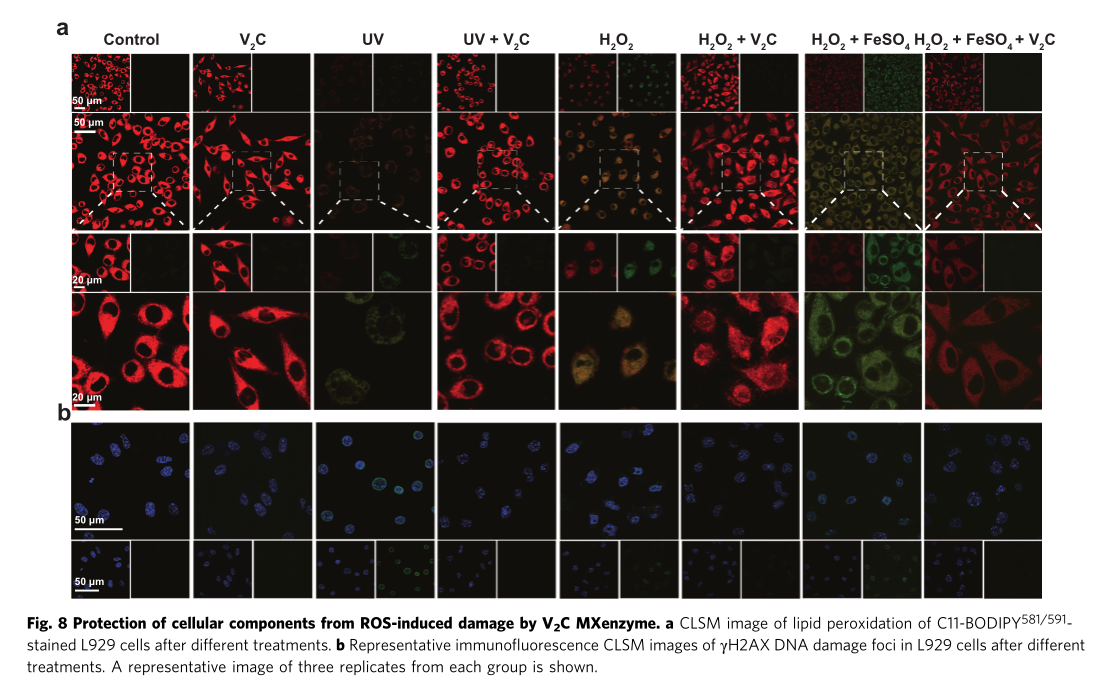
ROS荧光染色、死细胞/活细胞染色实验也均有效证明对V2C Mxenes对UV/Fetonn-H2O2试剂诱导的损伤具有优异活性氧清除能力。同时经V2C MXene处理的细胞其凋亡相关表达蛋白Cleaved caspase-3的表达量,蛋白质碳基化水平,细胞脂质体过氧化和DNA损伤水平也得以明显减少。
5、2D V2C MXenes体内抗炎活性以及对MPTP诱导的帕金森疾病的神经保护
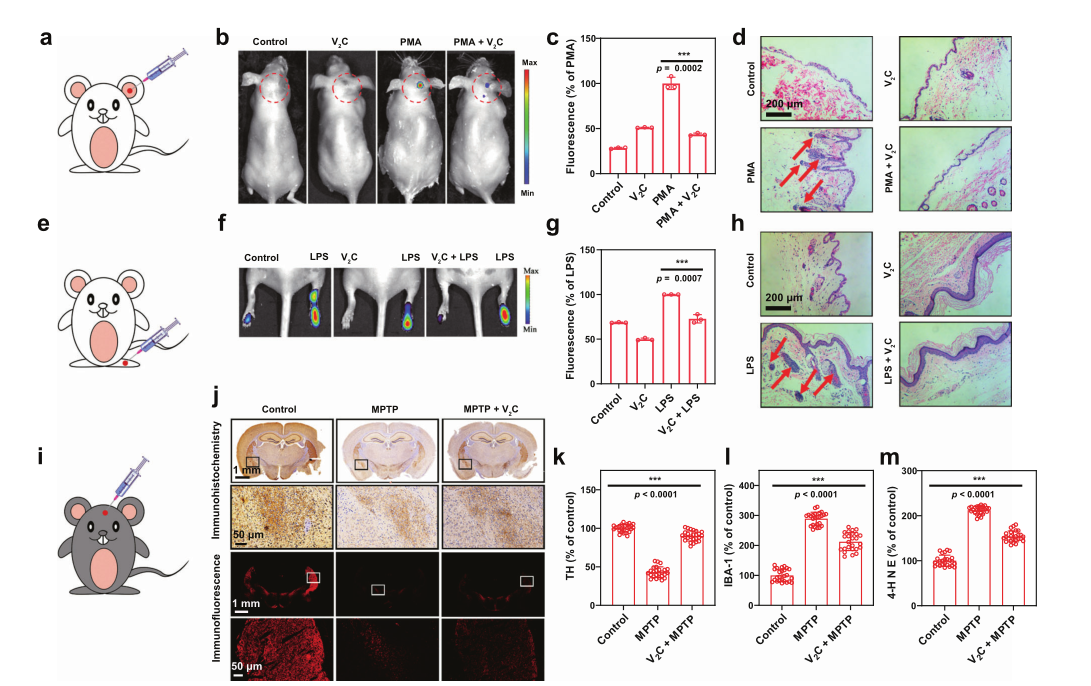
进一步研究人员探究了纳米酶在体内的抗炎活性,其血液学、血清生化以及组织学均表明静脉注射该材料不会明显引起动物体内的炎症、水肿、肺纤维化、增生、坏死和其他异常现象,证实了体内实验的安全性。随后作者使用PMA诱导小鼠耳朵生成急性局部刺激性皮炎,ROS荧光原位成像证明PMA诱导了活性氧的大量生成,而V2C MXene处理后的小鼠其荧光强度显著降低了56.5%。同时相较于PMA处理组,V2C MXene组小鼠的皮肤炎症明显缓解。在LPS诱导的急性脚踝炎症小鼠实验也可以看到类似的现象,以上均表明V2C MXene的广谱体内抗炎能力。同时考虑到氧化应激也与神经再生性疾病相关,研究人员利用MPTP来诱导小鼠构造帕金森小鼠模型并探究V2C MXene 对帕金森疾病治疗效果。结果发现与MPTP诱导的小鼠,其纹状体酪氨酸羟化酶的水平显著降低,而经V2C MXenes处理后的小鼠,其酪氨酸羟化酶水平(TH)明显更高,小胶质细胞活化的生物学指标离子钙结合接头分子1 (IBA-1) 明显下调,脂质体过氧化标志分子4-羟基壬烯酸(4-HNE) 的表达水平减少,这些都进一步证明材料通过抑制MPTP诱导的氧化应激来保护小鼠免受神经毒性。
6、V2C MXene多酶活性的机制分析
最后研究人员系统研究V2C MXene的多酶活性的可能机制,其中
SOD活性:作为中间电子载体,VIV可以与超氧化物反应并生成氢过氧化氧钒(VOOH),其中电子从VIV转移到O2−•。然后,VOOH的质子化伴随着H2O2的释放和VV再生。V2C MXene的氧化电位值,有效证明了V2C MXene具有催化O2−•歧化的能力。
CAT活性:当反应混合物中存在H2O2时,VV如 OVO+可被氧化形成C1单过氧化钒物质 OV(O2)+。此外,形成的OV(O2)+与另一个H2O2分子的相互作用导致产生C2双过氧化钒物质 HOOV(O)22+。VV和H2O2之间生成VIV和.OOH的反应在液氮温度 (-196℃) 下的电子自旋共振 (ESR) 光谱测量中得到证实。随后是OV2+补充,可变C3 m-过氧桥OVOOV(O2)+ 由于内部氧化断裂生成OVO+和C4氧-过氧自由基•OV(O2)2+。最后,分子氧(O2)通过.OV(O2)2+的歧化反应从反应体系中释放出来。
GPx活性:由于V2C MXenzyme为H2O2还原伴随GSH氧化提供反应位点。随后,作为质子载体的GSH将部分带负电的氧(δ-)质子化,同时GS- 作为亲核试剂攻击带正电的氧 (δ+),生成不稳定的磺酸盐结合中间体G2(GSOH),通过水解从而分解G3谷胱甘肽次磺酸(GSOH)和G4二羟基中间体。值得注意的是,该途径的GSOH可能是HOBr从钒依赖性卤代过氧化物酶中V-OBr中间体的迁移产生的。
POD活性机制:V原子应该充当路易斯酸位点,但用于桥接氧原子的电子键对表现为路易斯碱位点,其中,发生氧的亲核加成反应。随后,V2C MXene应该与H2O2反应形成中间体V-过氧 (P1) 物,然后TMB底物通过亲核攻击与V-过氧复合物结合形成P2,从而允许TMB的氧化反应形成TMB*+物。由于H2O2是一种双电子氧化剂,因此V2C MXene再生需要另一个TMB分子来诱导TMBox形成。
三、结 论
本工作主要报道了一种具有SOD/CAT/POD/GPx/TPx/HPD类酶活性的V2C MXenes, 该纳米酶可以模拟细胞内抗氧化防御系统对抗 ROS 介导的关键氧化损伤(例如,蛋白质羰基化、脂质过氧化和DNA损伤),从而将过渡态金属碳/氮化物从传统的化学催化和储能领域扩展为催化生物医学用途。体内体外实验均有效证实V2C MXenzyme 不仅显示出满意的生物相容性同时可以通过催化反应去除活性氧来保护细胞成分抵抗氧化应激损伤。综上所述,该MXenzyme是一类可用于多种炎症和神经退行性疾病治疗的特定应用的有价值的工具。



 返回列表
返回列表